上观新闻:重大改革落地!全国首个医疗器械注册人制度试点产品获准上市
2018-02-28
保护视力色: 杏仁黄 秋叶褐 胭脂红 芥末绿 天蓝 雪青 灰 默认 【字体: 大 中 小 】 打印本页 关闭窗口
2月27日,上海市食药监局向上海远心医疗科技有限公司(以下简称“远心医疗”)的单道心电记录仪颁发医疗器械注册证,向上海微创电生理医疗科技股份有限公司颁发医疗器械生产许可证,该产品成为《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》颁布施行后获批上市的首个医疗器械产品,意味着上海去年推出的医疗器械注册人制度创新改革正式落地。

窗口工作人员向企业代表发证
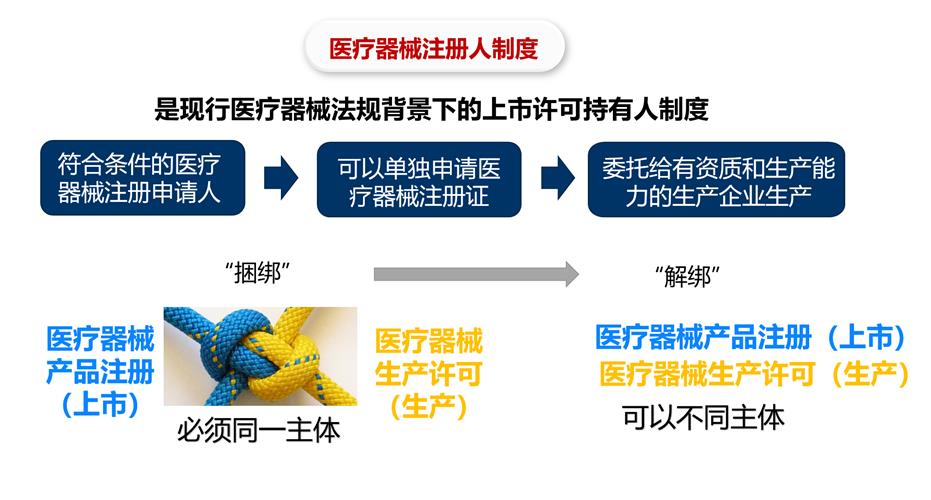
以往,我国医疗器械的注册与生产两大环节被“捆绑”在一起,必须由一个主体来完成注册与生产。这意味着,要么由医疗器械注册人自己设厂生产,要么由具备医疗器械注册证和生产许可证的企业来申请办理。这种“捆绑”模式影响了创新研发和持续提高产品质量的热情,也限制了创新要素合理配置,与国际通行规则和我国《医疗器械监督管理条例》的立法精神不符。
起初申请相关许可时,远心医疗就遇到了难处。该企业是注册于上海自贸区内的研发型公司,持有单道心电记录仪技术,主要用于采集心电信号后通过蓝牙传输至移动终端,具有体积小巧、便于携带、可较长时间监测心电趋势的特点,然而远心医疗并不具备生产能力。在改革前,如要取得医疗器械注册证,远心医疗即使有技术,也必须走拿地、办厂、取得生产许可证这一条路,这是一笔巨大的投资;即使把厂建起来了,头一两年主要精力要放在生产许可证的申请上,工厂相当于空转,如果没有雄厚的资金基础,很难熬到“拨云见日”那天。

单道心电记录仪与配套的手机软件
了解到企业的难处,上海食药监管部门立即开展调研,发现远心医疗是上海微创集团的子公司,而该集团及下属其他企业具备相关的医疗器械生产能力,如果还按照死板的“老路”走,既是对研发企业的“煎熬”,也是对现成生产资源的浪费,何不让研发企业试走一下全新的创新改革通道?
在医疗器械审批部门的指导下,远心医疗专注于医疗器械注册证的申请,成为注册人后,委托上海微创集团内生产型企业生产样品及成品,最终后者通过严格审评,获得生产许可。整个过程中,上海食药监局秉持“强制标准不降低、法定程序不减少”,通过纳入优先审批程序、同步开展产品注册和生产许可体系核查等措施,加快产品上市时间,产品从正式受理至准予上市仅用时26个工作日,比法定工作时限缩短了82%。
“医疗器械产业专业细分程度相当高,上海的改革让研发者和生产者‘术业有专攻’,实现了扬长避短、互补共赢,可以说政府部门对先进产业的特征是熟悉的,政策是与时俱进的。”上海微创电生理医疗科技股份有限公司总裁孙毅勇表示,上海推出的医疗器械注册人制度创新改革让单道心电记录仪的上市时间足足提前了一年,节省了100万元左右的生产性投资。更重要的是,国内外企业都在研发类似产品,越早上市越能抢占市场先机。孙毅勇透露,结构组成中含有“数据管理软件”和“服务器前端软件”的心电记录仪,目前上海审批发证的只有远心医疗,拿到许可后,企业所有员工都兴奋不已。
上海市食药监局副局长徐徕表示,我国医疗器械产业高速发展后,产能过剩逐渐成为显著问题,上海此次改革就是要通过制度“松绑”,合理配置上海医疗器械研发、生产资源。可以预见,改革将夯实上海医疗器械产业的“平台经济”,由专业的企业进行研发、生产,分工协同,做强做大;有利于突破土地资源和环境资源的约束,促进强强联合;有利于加快新的医疗器械上市,落实供给侧改革,满足市民对优质、价格合理产品的需求;有利于集聚医疗器械科研人员、研发机构、创新企业,助推上海科创中心建设。

据透露,国家食药监总局2018年1月5日发布《关于上海市食品药品监督管理局开展医疗器械注册人制度试点工作的公告》至今,上海自贸区内已有20多家企业有意向参与试点,其中1家许可申请已经受理,还有2家5个产品已经进入受理前的检查阶段。
此外,对于医疗器械上市后的监管,上海将从严。各级监管部门将通过检查、监测、抽验和信息公开等手段,加强对注册人履行保证医疗器械质量、上市销售与服务、医疗器械不良事件监测与评价、医疗器械召回等义务情况的监督管理。对于评级为高风险的企业,上海将重点增加检查频次和力度,并加强对于违法违规行为的惩戒力度。(摘自上观新闻)